Todas las ciencias utilizan en mayor o menor medida las matemáticas, aunque la física es sin duda la que mayor provecho ha sacado de ellas. Cuanto más alejada se encuentra una ciencia de los fenómenos físicos, más difícil resulta utilizar en ella las matemáticas clásicas y más necesario se hace el recurrir a métodos estadísticos. Podría creerse que la física es determinista y que, sólo al alejarnos de ella, es necesario introducir el elemento de azar que reflejaría cierto grado de ignorancia. Sin embargo, durante la primera mitad del siglo XX se realizaron descubrimientos extraordinarios en la física, en concreto en la estructura atómica de la materia, que condujeron a la necesidad de crear un modelo matemático, intrínsecamente aleatorio, para explicar el comportamiento del mundo atómico y subatómico.
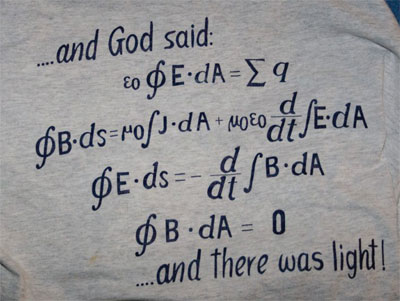
Como suele ocurrir, un hallazgo de esta relevancia propició la creación de una nueva rama de la física, llamada esta vez mecánica cuántica. Niels Bohr, Heisenberg, Schrödinger y otros físicos llegaron a la conclusión de que si había un modelo matemático para el comportamiento de los electrones alrededor del núcleo en un átomo, éste debería incluir elementos de azar. De hecho, existe algo intrínsicamente aleatorio en la naturaleza. No se trata de simple falta de datos lo que nos lleva a introducir el elemento de azar sino que, en realidad, las partículas subatómicas tienen un comportamiento esencialmente aleatorio. Por ejemplo, al lanzar una partícula sobre una pared con dos pequeños huecos, puede que choque sin pasar por los huecos o, también, puede ser que pase por ellos, pero el que pase o no, no depende de manera determinista de la posición y velocidad inicial de la partícula, como ocurriría en el campo de la mecánica newtoniana que se aplica a los cuerpos macroscópicos. En el caso de las partículas elementales es imposible determinar con precisión absoluta la posición y velocidad inicial de una de ellas, es más: cuanto mejor definida esté su posición, menos definida estará su velocidad y viceversa. Esto se llama el principio de incertidumbre de Heisenberg y tiene una formulación matemática muy precisa:
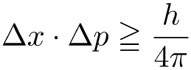
donde Δx es la incertidumbre en la posición, Δp la incertidumbre en la cantidad de movimiento íntimamente relacionado con la velocidad, y h es una constante, llamada la constante de Planck. El concepto de incertidumbre es equivalente al de desviación estándar que se usa en la estadística. El principio de incertidumbre dice que ninguna de las dos incertidumbres Δx o Δp puede ser cero y que si una de ellas es muy pequeña, la otra deberá ser muy grande. Schrödinger encontró una ecuación que describe la distribución de probabilidad de que un electrón —de un átomo— se encuentre en algún punto del espacio alrededor del núcleo:
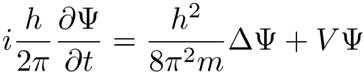
La anterior es la ecuación de Schrödinger para la amplitud de onda ψ.
|ψ|2 es la densidad de probabilidad de la posición de una partícula.
La ecuación de Schrödinger, además, resulta ser una ecuación de onda, similar a la que describe el campo electromagnético, por lo cual surge la posibilidad de que los electrones de un átomo y las partículas elementales, en general, tengan un comportamiento ondulatorio. De Broglie predice que las partículas podrían comportarse como ondas; al final se demuestra experimentalmente que en verdad sucede así: al cruzar por una rendija, los electrones exhiben un comportamiento típico de las ondas: interferencia.

La distribución de electrones que han pasado a través de una rendija se parece mucho a la de la luz que pasa por una mirilla, similitud por la cual la ciencia estaba convencida de que la luz es un fenómeno ondulatorio. Se pensaba que la luz consistía probablemente en ondas electromagnéticas, pues la velocidad de estas ondas, de acuerdo con las ecuaciones de Maxwell, era exactamente la misma que se había medido para la luz: 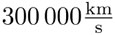
De nuevo, al crear un modelo matemático para describir un fenómeno se llega a un descubrimiento científico: la materia exhibe un comportamiento ondulatorio. Ya con anterioridad el trabajo de Planck sobre la radiación del cuerpo negro, y el de Einstein sobre el efecto fotoeléctrico, habían sugerido que la luz, considerada en aquel momento como ondas electromagnéticas, se comportaba como si estuviera constituida por pequeñas partículas llamadas "cuantos". Ahora se deducía que lo contrario también era cierto, las partículas de las que estaba constituida la materia se comportaban como ondas. "¿Qué onda?", se preguntaría asombrado un joven mexicano... Por fin, ¿la luz es onda o partícula?, y la materia, ¿es onda o partícula? La conclusión de todas estas interrogantes e investigaciones es increíble: la luz y también la materia son ambas, onda y partícula. Hay una realidad dual. Quizá es difícil comprenderlo —igual que fue difícil entender el concepto del continuo y los límites—, pero esta dualidad pasó a ser un principio fundamental de la física que, apoyado en fórmulas matemáticas, permite describir el comportamiento aleatorio de las partículas-ondas de la materia y la luz.

La física subatómica tiene aún muchos enigmas y cuestionamientos, y lleva años buscando su Santo Grial, es decir, una teoría unificada que, en caso de existir, consistiría en un conjunto de fórmulas matemáticas capaces de describir el comportamiento de la materiaenergía, relacionándolas con todas las interacciones de la naturaleza, de las cuales hoy se conocen cuatro: la gravedad, el electromagnetismo, las interacciones nucleares débiles y las interacciones nucleares fuertes.