Hacia 1860 en el Primer Congreso Internacional de Química, celebrado en Karlsruhe, Alemania, el químico Stanislao Cannizaro (1826-1910) propuso aprovechar las propiedades físicas de los elementos para establecer correctamente sus masas atómicas relativas. En ese mismo congreso se encontraba el ya reconocido químico ruso Dimitri Mendeleiev (1834-1907), quien tomando en cuenta los valores de las masas atómicas corregidas por Cannizaro propuso la primera tabla periódica de los elementos. La propuesta de Mendeleiev tomaba en cuenta, no sólo las masas atómicas, sino también propiedades físicas como volumen atómico, color, gravedad específica y propiedades químicas como su reactividad en agua (tanto del elemento como de sus óxidos) y en ácidos o bases, entre otras. Mendeleiev ordenó los elementos en ocho grupos, según se observa en la siguiente tabla.
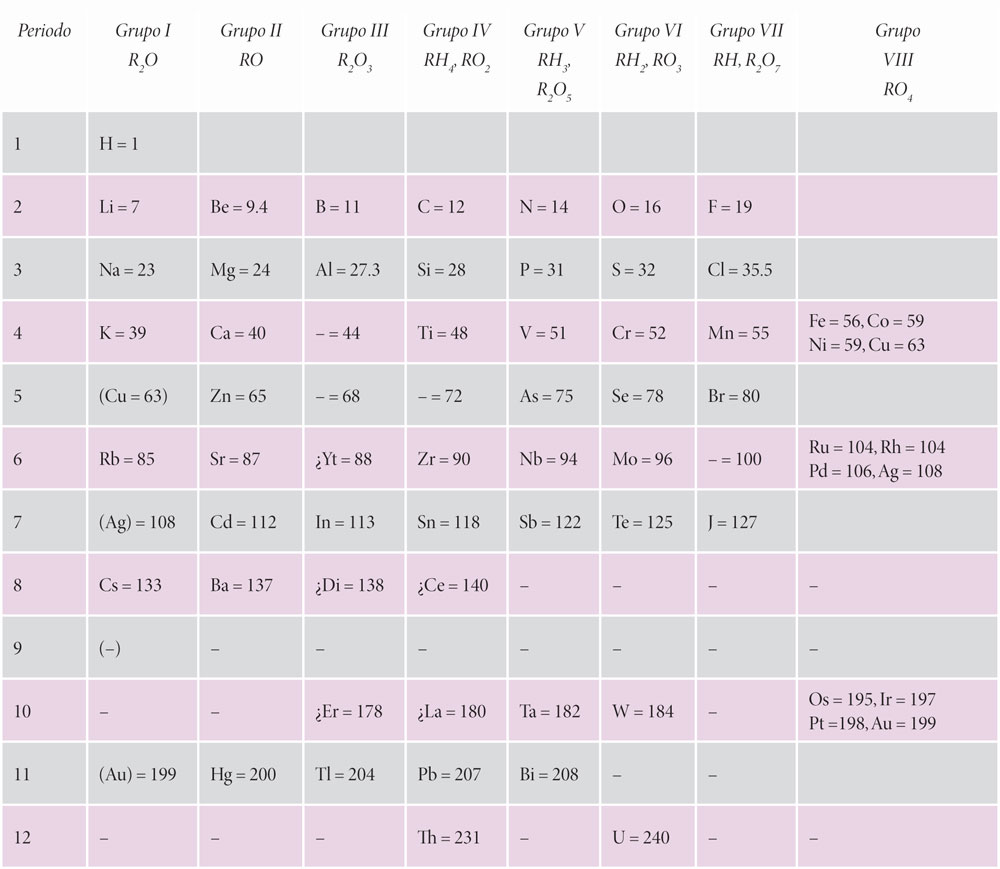
Algo muy importante que hizo Mendeleiev, y de ahí lo valioso de su tabla, fue la predicción de la existencia de elementos no conocidos hasta entonces, para los cuales dejó espacios. Lo interesante es que no sólo predijo el lugar que les correspondería en la tabla, sino además las propiedades de sustancias que aún no se conocían.

Una vez determinado que la diferencia fundamental entre los distintos tipos de átomos era su número atómico se hicieron algunas modificaciones en la ubicación de algunas casillas y ahora los elementos se encuentran acomodados con base en este número.
La ciencia se caracteriza por su evolución constante. Aunque pareciera que Mendeleiev descubrió el arreglo perfecto, los conocimientos sobre la estructura del átomo avanzan y persisten los debates sobre si ésta será la mejor manera o la más útil de acomodar a los elementos. Es así que a la fecha se han propuesto arreglos alternativos de la tabla periódica, algunos tridimensionales, que seguramente no reconocería ni el mismo Mendeleiev.

La tabla periódica está dividida en diferentes casillas, las cuales contienen información básica relativa al átomo que se está representando. Por ejemplo, la casilla del hidrógeno, contiene el símbolo H con un número 1 pequeño en la esquina superior izquierda. En cambio la casilla del flúor contiene el símbolo F con un número 19 en la misma esquina que la casilla anterior. A nivel macroscópico esto significa que cualquier conjunto de átomos de flúor tendrá 19 veces más masa que otro conjunto igual de átomos de hidrógeno. A nivel nanoscópico esto significa que un átomo de flúor tiene 19 veces más masa que un átomo de hidrógeno. Esta conclusión que parece tan sencilla, constituyó un avance fundamental en el desarrollo de la química.
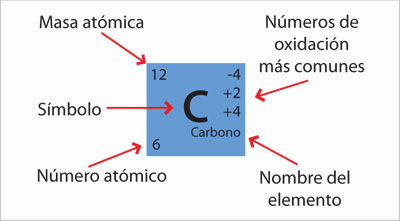
El número atómico, que se encuentra en la esquina inferior izquierda de cada casilla, corresponde al número de protones que tiene un átomo. Es el número que lo define; si éste cambia, cambia el átomo.
Por ejemplo, el número atómico del hidrógeno es 1 porque tiene un protón, el del helio es 2 porque tiene dos protones, el del litio es 3 porque tiene tres protones, y así sucesivamente.