En todas las reacciones químicas unas sustancias se transforman en otras, la masa se conserva y los enlaces entre los átomos se modifican. Para entender qué es lo que cambia de las sustancias cuando hay una reacción química es importante recordar que todo está formado por átomos, que las propiedades de las sustancias dependen de cómo se arreglan y enlazan los mismos, y que éstos no se modifican cuando las sustancias reaccionan. En las reacciones químicas, la identidad de cada átomo sigue siendo la misma, es decir, todos los átomos permanecen iguales, antes y después de cada cambio químico.
En una reacción química las nuevas sustancias se forman porque algunos de los átomos se unen y otros se separan. Por ejemplo, los que estaban formando una red en un reactivo sólido, tras la reacción, pueden integrarse en otra red en un sólido diferente o agruparse y convertirse en algún gas. Los átomos o los iones que estaban formando una sustancia pasan a formar otra al unirse en un arreglo diferente. Así se producen nuevas sustancias y la materia original se transforma. Una reacción química consiste sólo en un reordenamiento de los átomos que lleva a la formación de sustancias diferentes a las originales, pero con los mismos átomos que estaban al inicio. Lo único que cambia en una reacción es la forma en que los átomos están enlazados.
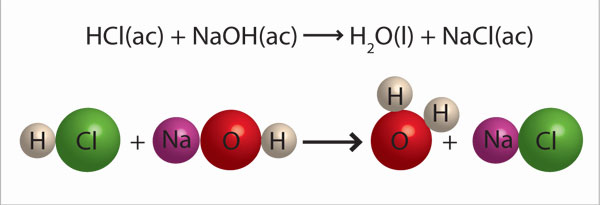
Por ejemplo, la reacción entre el ácido clorhídrico acuoso (HCl(ac)) y el hidróxido de sodio acuoso (NaOH(ac)) se representa con la ecuación química de la derecha:
Al inicio, el sodio (Na) que aparece del lado izquierdo de la flecha formaba una sustancia con el oxígeno y el hidrógeno (NaOH), pero del lado derecho de la flecha, después de la reacción, forma otra sustancia, ahora con el cloro (NaCl). De la misma manera, el hidrógeno del ácido se mezcla con el hidróxido (OH–) y forma agua (H2O). Las sustancias formadas son otras y por lo tanto las propiedades que se observan también son distintas. Si se cuenta el número de veces que aparece el símbolo de cada átomo en cada uno de los lados de la ecuación química se verá que no cambia. Del lado izquierdo de la flecha (donde se escriben las fórmulas de los reactivos) aparece dos veces el símbolo del hidrógeno (H): una en la fórmula HCl y otra en la fórmula NaOH. También aparece una vez el símbolo del cloro en el HCl, una vez el del sodio en el NaOH y una vez el del oxígeno, también en el NaOH. Del lado derecho de la flecha (donde se escriben las fórmulas de los productos) hay el mismo número de símbolos que representan los diferentes tipos de átomos. Esto es porque la masa se conserva. En resumen, microscópicamente lo único que cambia en una reacción química es el acomodo de los átomos que forman las sustancias; es decir, el número y tipo de átomos no cambia porque la masa se conserva.