Cuando una varilla de construcción es nueva su color es plateado y brillante, pero si se deja a la intemperie tarde o temprano empieza a formarse en su superficie un polvo café. Esto se debe a que el hierro de la varilla reacciona con el oxígeno del aire para formar varios óxidos. El más estable en las condiciones ambientales es un polvo de color café que se llama óxido de hierro (III), conocido históricamente como óxido férrico.
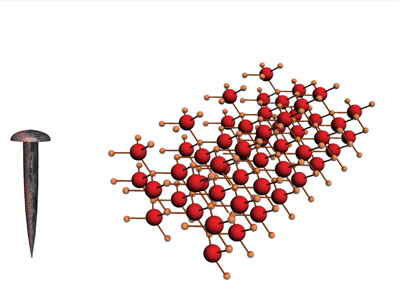
Esto es lo que se observa a nivel macroscópico. Lo que sucede al interior, con los átomos, es lo siguiente: antes de la reacción, los átomos de hierro (Fe) se encuentran acomodados en una red metálica de muchísimos átomos todos iguales. Eso se observa como metal brillante y plateado. El oxígeno que forma parte de la mezcla de gases conocido como aire es un gas incoloro formado por conjuntos con dos átomos cada uno, cuya fórmula es O2. Al entrar en contacto, los átomos de oxígeno interaccionan con los átomos del metal. Todos los átomos involucrados experimentan un reacomodo y entonces se forma una nueva sustancia que antes no estaba: el óxido de hierro (III), cuya fórmula es Fe2O3. Éste es el polvo café observado en todos los objetos que tienen hierro y están oxidados. Algunos profesionales, como los ingenieros químicos metalúrgicos, enfocan sus estudios para evitar la oxidación del hierro y así lograr que los productos hechos con ese metal duren más.
A nivel atómico, este polvo café tiene una estructura de red iónica formada por iones Fe3+ y O2- en una proporción de 2 a 3, lo cual significa que en el óxido de hierro Fe2O3, por cada dos iones de hierro (Fe3+) hay dos iones óxido (O2-). La ecuación que representa esta reacción es:
4Fe(s) + 3O2(g) —› 2 Fe2O3(s)
Los coeficientes estequiométricos de la ecuación química que representa el proceso de oxidación del hierro con oxígeno son 4, 3 y 2, respectivamente. Estos números sirven para entender que por cada cuatro átomos de hierro combinados con dos conjuntos de oxígeno diatómico, se producirán dos redes iónicas de óxido de hierro (III). La reacción siempre ocurrirá en esa proporción: 4:3:2.
Una reacción química da información acerca de la cantidad de sustancia que está reaccionando y de la forma en que se está llevando a cabo la reacción. Por ejemplo, la reacción del yoduro de potasio con nitrato de plomo (II) en disolución acuosa. La estructura interna de estas sustancias consiste en la formación de redes iónicas; sin embargo, cuando se encuentran en disolución acuosa se disocian. Una forma sencilla de representar la ecuación química es escribiendo los iones en lugar de la fórmula completa.
2K+(ac) + 2I-(ac) + Pb2+(ac) + 2NO3 -(ac) —› PbI2(s) + 2K+(ac) + 2 NO3-(ac)
En esta ecuación todo está disociado (separado) del lado de los reactivos. Es decir, todas las sustancias iónicas se disuelven en agua para formar iones. Por el contrario, del lado de los productos, hay una sustancia que no se encuentra disociada, el yoduro de plomo (II), y otra que sí lo está. Cuando en un cambio químico se observa la formación de un sólido, significa que ese sólido se forma en la reacción y no se disuelve en agua. El yoduro de plomo (II) es sólido y por eso no se disocia. Con esta forma de representación se sabe qué sustancias se encuentran disociadas y cuáles no.