La cantidad de sustancia es una magnitud química por excelencia y se utiliza para cuantificar las partículas (átomos, moléculas, iones, electrones, etc.) que intervienen en las reacciones químicas, pero haciendo uso de números pequeños. Es una magnitud macroscópica, a diferencia de su contraparte N (número de partículas), la cual es una magnitud nanoscópica. La magnitud N representa el número de partículas de una determinada sustancia involucrada en los cambios químicos; sin embargo, las cantidades que representa son muy grandes, tan grandes que son semejantes a la distancia que existe de la Tierra al centro de la Vía Láctea, es decir cantidades del orden de 1020 o mayores. Ahora bien, para saber el número de partículas contenidas en 350 ml. de agua es necesario conocer cómo se relacionan las magnitudes cantidad de sustancia y número de partículas. Esta relación fue propuesta por Avogadro en su hipótesis acerca de que las sustancias se combinan a través de números enteros y pequeños, pero a nivel nanóscopico estas combinaciones se dan en cantidades de número de partículas. Es decir la cantidad de sustancia es proporcional al número de partículas n ∝ N . Por ello se relacionan a través de una constante que cumple con la característica de tener las unidades de número de partícula/cantidad de sustancia (partículas/mol). Esta constante se ha determinado experimentalmente y se le conoce como constante de Avogadro (NA) (llamada así en honor a Amadeo Avogadro) y tiene un valor de 6.022 × 1023 partículas/mol. Sin embargo, esta constante no relaciona de forma directa a las magnitudes macroscópica y nanoscópica, sino que las relaciona de forma inversa, es decir 1/NA; por lo que la expresión matemática para relacionar cantidad de sustancia y número de partículas es:
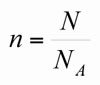
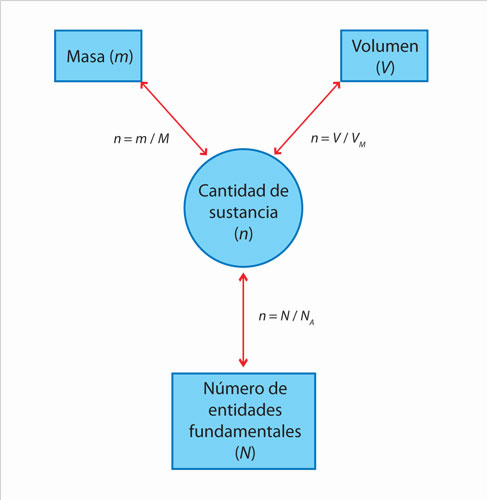
Dado que la magnitud cantidad de sustancia (n) no puede determinarse de forma experimental, se usan otras magnitudes macroscópicas como son la masa (m) y el volumen (V) de las sustancias. Para esta última, es posible aplicar directamente los resultados reportados por Gay- Lussac para el agua. Este investigador estudió la síntesis de agua a partir de hidrógeno y oxígeno, y encontró que por cada dos volúmenes de hidrógeno se requiere un volumen de oxígeno y se obtienen dos volúmenes de agua. Por ejemplo:
300mL H2 (g) + 150mL O2(g) 300ml. H2O(g)
Si se analiza la propuesta de Gay-Lussac se observa que esta idea de relacionar volúmenes tiene que ver con el número de partículas y, por tanto, con la cantidad de sustancia. Es decir n es proporcional a V (n ∝ V ). En este caso, se ha encontrado que para cualquier gas en condiciones ideales con un volumen de 22.4 L siempre se tiene el mismo número de partículas; por ello este volumen se considera la constante que relaciona a la cantidad de sustancia y al volumen, y se conoce como volumen molar (Vm = 22.4 L/mol). Sin embargo, cuando se habla de reacciones químicas como la expresada anteriormente, basta con obtener las razones entre los volúmenes de los gases reaccionantes para determinar los coeficientes estequiométricos, y por tanto, la cantidad de sustancia reaccionante. En este caso las relaciones H2:O2 son dos a uno, es decir se requieren 2 mol de hidrógeno por cada mol de oxígeno. Lo que expresado en una reacción química quedaría:
2H2(g) + O2(g) 2H2O(g)
Esto sienta las bases para un lenguaje químico, como ya se ha estudiado anteriormente.
Así como la cantidad de sustancia expresa cuánto de cada reactivo y producto es requerido o producido, en las reacciones químicas expresa además cómo están constituidas las sustancias. Por ejemplo, para la molécula de oxígeno (O2) se dice que se tienen dos átomos de oxígeno (O) por cada molécula de oxígeno; en cambio para el ozono (O3) se tienen tres átomos de oxígeno por cada molécula de ozono. Si se quiere traducir esto a términos macroscópicos es necesario utilizar cantidades de sustancia, por lo que para cada 1 mol de moléculas de oxígeno (O2) se tienen 2 mol de átomos de oxígeno, y para cada 1 mol de moléculas de ozono (O3) se tienen 3 mol de átomos de oxígeno.
Aquí es importante remarcar que cuando se habla de una sustancia se hace referencia a cantidades macroscópicas y a las propiedades que como bulto se presentan. En este sentido, se habla de que los átomos por sí mismos no manifiestan propiedades como el color o la temperatura de fusión características del bulto. Por ejemplo, cuando a un alumno se le cuestiona sobre el color de los átomos de cobre suele contestar que tienen un color café-rojizo, es decir le asignan al átomo una propiedad que es puramente del bulto, es decir macroscópica.
Otra forma de determinar cantidades de sustancia es a través de la masa, la cual se especifica de forma sencilla utilizando una balanza. Esta magnitud se relaciona en forma proporcional con la cantidad de sustancia, es decir, si aumenta la masa de la sustancia aumenta su cantidad de sustancia. Sin embargo, la masa no es una magnitud que facilite los cálculos químicos, pues las sustancias no reaccionan en términos de masa, sino en términos de cantidades de sustancia. Otro punto importante es que así como N y V se relacionan con n a través de una constante, la masa también se relaciona con n a través de una constante; sin embargo, esta última es característica de la sustancia que se esté estudiando y no es posible utilizarla para cualquier otra sustancia. La relación entre n y m es:
donde M es la masa molar relativa de cada sustancia que tiene unidades de masa por cantidad de sustancia (g/mol). Por ejemplo, si se quiere determinar la cantidad de sustancia de 10 g de hierro (Fe), la masa molar relativa del hierro es 55.85 g/mol. Así pues, la cantidad de sustancia de hierro contenida en una masa igual a 10 g de hierro es 0.179 mol. Si se hiciera esto mismo para 10 g de cloruro de sodio (NaCl), al ser la masa molar relativa de esta sustancia M = 58.44 g/mol, la cantidad de sustancia de NaCl contenida en 10 g de esta sustancia sería 0.1711 mol. Por tanto, aunque se tengan masas iguales de sustancias distintas, la cantidad de sustancia será diferente.
En el siguiente diagrama se muestran las tres relaciones de n con m, N y V.